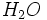Ø Os átomos são tão pequenos que não podemos vê-los a olho nu. Para dar uma noção de alguns tamanhos, aqui estão diâmetros aproximados de vários átomos e partículas:
Ø átomo = 1 x 10-10 metros
Ø núcleo = de 1 x 10-15 a 1 x 10 -14 metros
Ø nêutron ou próton = 1 x 10-15 metros
Ø elétron - não se sabe com exatidão, mas acredita-se que seja algo da ordem de 1 x 10-18 metros
Ø É impossível ver um átomo com um microscópio de luz. No entanto, em 1981, foi criado um tipo de microscópio chamado de microscópio eletrônico de tunelamento (STM). O STM consiste no seguinte:
Ø uma ponta muito pequena e afiada que conduz eletricidade (sonda);
Ø um dispositivo de varredura rápida piezoelétrica no qual é encaixada a ponta;
Ø componentes eletrônicos que fornecem corrente elétrica à ponta, controlam o dispositivo de varredura e aceitam os sinais do sensor de movimento;
Ø um computador para controlar o sistema e fazer a análise dos dados (coletar, processar e exibir dados);
Ø O STM funciona assim:
Ø uma corrente é fornecida à ponta (sonda) enquanto o dispositivo de varredura (scanner) move a ponta rapidamente pela superfície de uma amostra condutora;
Ø quando a ponta encontra um átomo, o fluxo de elétrons entre o átomo e a ponta muda;
Ø o computador registra a mudança na corrente com a posição x,y do átomo;
Ø o scanner continua a posicionar a ponta sobre cada ponto x,y da superfície de amostra, registrando uma corrente para cada ponto;
Ø o computador coleta os dados e desenha um mapa da corrente sobre a superfície que corresponde a um mapa das posições atômicas;
Ø O processo é muito parecido com uma velha vitrola, em que a agulha é a ponta e as ranhuras no disco de vinil são os átomos. A ponta do STM se move sobre o contorno atômico da superfície, usando corrente de tunelamento como um detector sensível da posição atômica.




 Rim artificial implantável promete acabar com diálise
Rim artificial implantável promete acabar com diálise